初中化学人教版9年级上下全册知识点 - 第八单元 金属和金属材料
第八单元 金属和金属材料
课题1 金属材料
一、几种重要的金属
1、金属材料包括纯金属和合金。
2、人类使用最多的金属材料:cu、fe、al及其合金。
注:al与fe相比的优点:密度小、耐腐蚀。
3、金属的物理性质:除汞外,均为固体;有金属光泽;易导电、导热;有延展性。
二、合金
1、合金:在金属中加热熔合某些金属或非金属而形成的具有金属特性的混合物。
2、合金是混合物,而不是化合物。
形成合金的过程不是混合,也不是化合,是熔合。
合金中至少含一种金属。
3、合金的特性:比形成合金的金属硬度大、强度高、更耐腐蚀。
但熔点比形成合金的金属熔点低。
注:鉴别黄铜和黄金的方法:取样品放入稀盐酸或稀硫酸中,若有气泡产生,则为黄铜,反之为黄金。
(反应原理:zn 2hcl==zncl2 h2↑或zn h2so4==znso4 h2↑)
课题2 金属的化学性质
一、金属的化学性质
1、mg与al常温下就能与o2反应。
2、fe与cu在高温时才与能反应。结论:mg、al比较活泼,fe与cu次之,
3、au、pt在高温时也不与o2反应。au、pt最不活泼。
注:mg、al具有很好的抗腐蚀性的原因:因为mg或al在空气中与氧气反应生成了致密的氧化膜,阻止里面的金属进一步氧化。
二、金属活动性顺序:kcanamgalznfesnpb(h)cuhgagptau
1、常见金属在溶液里的活动性顺序。k→au,金属活动性由强到弱。
2、金属活动性顺序的应用:
①判断金属能否与酸(hcl 、h2so4)反应。
②判断金属与酸(hcl、h2so4)反应的剧烈程度。
③判断金属能否与盐溶液发生反应。
3、设计实验证明金属活动性顺序的方法:
方法一:利用金属能否与酸反应以及与酸反应的剧烈程度来证明。
方法二:利用金属于盐溶液之间的反应来证明。
◆例1:设计实验证明fe比cu活泼。
方法一:将铁片和铜片分别放入相同浓度的盐酸,铁片上有气泡,铜片无。
方法二:将铁片浸入cuso4溶液中,过一段时间后,铁片上有红色物质覆盖。
方法三:将铜片浸入 feso4溶液中,无明显现象。
◆例2:设计实验证明fe、cu、ag活泼活泼性。
方法一:用cu分别与fe(no3)2、agno3反应。
方法二:用fe、ag分别与cu(no3)2反应。
注:fe与hcl 、h2so4 、cuso4等发生置换反应时,生成亚铁化合物(即二价铁)。
4、置换反应:由一种单质与一种化合物反应,生成另一种单质与化合物的反应。
①置换反应:a bc == b ac
②化合反应:a b== ab
③分解反应:ab== a b
④复分解反应:ab cd == ad cb
三、金属的化学性质小结
1、金属 氧气 →金属氧化物。
① 4al 3o2 2al2o3(注意:不要把al2o3写成alo)
2al2o3(注意:不要把al2o3写成alo)
② 2mg o2 2 mgo(注意:不要把mgo写成mgo2)
2 mgo(注意:不要把mgo写成mgo2)
③ 3fe 2o2 fe3o4(注意:不要把fe3o4写成fe2o3)
fe3o4(注意:不要把fe3o4写成fe2o3)
④ 2cu o2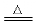 2cuo(注意:不要把
2cuo(注意:不要把 写成
写成 )
)
2、金属 酸 →盐 h2↑(条件:①金属比活泼;②酸为盐酸、稀硫酸)
补充:盐的概念:由金属离子或铵根离子与酸根离子(cl-、so42-、no3-等)组成的化合物,如nacl、na2so4、nano3等。
① zn 2hcl == zncl2 h2↑zn h2so4 == znso4 h2↑
② mg 2hcl == mgcl2 h2↑ mg h2so4 == mgso4 h2↑
③fe 2hcl ==fecl2 h2↑fe h2so4 ==feso4 h2↑
④2al 6hcl ==2alcl3 3h2↑2al 3h2so4 == al2(so4)3 3h2↑
注:
(1) 相同质量的mg al zn fe与足量的盐酸、稀硫酸反应。产生h2的量:
al >mg>fe> zn
(2) 相同质量的盐酸、稀硫酸与足量的mg al zn fe反应。产生h2的量:
al = mg = fe = zn
(3) 以上两种情况下,产生h2的速率:mg > al > zn > fe
3、金属 盐→新金属 新盐
条件:①反应物中的金属比盐中金属活泼;②盐必须溶于水;③k ca na除外
① fe cuso4 == feso4 cu(注意生成物中铁元素显 2价)
②2al 3cuso4 == al2(so4)3 3cu
③ cu 2agno3 == 2ag cu(no3)2
④ cu 2hg(no3)2== 2hg cu(no3)2
注意:①多种金属与同一化合物反应时,最活泼的金属先反应。如:fe、cu混合物同时放入agno3溶液中,fe先反应。
②同一金属与多种盐反应时,先置换出最不活泼的金属。如:fe与agno3和cu(no3)2 的混合液作用时,先置换出ag
课题3 金属资源的利用和保护
■金属资源除金、银等少数以单质形式存在外,其余都以化合物形式存在。
■工业上把用来提炼金属的矿物叫矿石,矿石是混合物。
■金属被开发和利用的先后与金属的活动性有关,越活泼利用越晚。
一、铁的冶炼
1、原料:铁矿石、焦炭、石灰石。
2、设备:高炉。
3、原理:3co fe2o3 2fe 3co2(注意,不是c还原fe2o3 。)
2fe 3co2(注意,不是c还原fe2o3 。)
4 、co还原fe2o3实验:
现象:红色粉末变为黑色、石灰水变浑浊、尾气燃烧产生蓝色火焰。
化学方程式 : 3co fe2o3 2fe 3co2
2fe 3co2
co2 ca(oh)2 = caco3 ↓ h2o
2co o2 2co2
2co2
注意:
①要先通co再加热,以防止爆炸。
②反应完全后,要先停止加热,再停止通co,防止生成的铁被空气中的氧气氧化。
③尾气必须点燃处理,以防止污染空气。
二、金属资源的保护。
1、金属的腐蚀和防护
铁生锈的条件:铁与水、氧气同时接触。
2、防止铁生锈的措施:
①保持铁制品表面洁净、干燥。
②在铁制品表面覆盖保护层.如:涂油或刷漆、镀一层不易锈蚀的金属。
③将铁制成不锈钢。
3、金属资源保护:
① 防止金属的腐蚀。② 回收就、利用废旧金属。
③ 合理有效的开采矿物 ④ 寻找金属的代用品。
4、铁锈是混合物,主要成分是fe2o3 .xh2o,铁锈疏松,不能阻碍里层的铁继续生锈,所以要及时除去铁锈,否则会加速铁的锈蚀。
扫描二维码推送至手机访问。
特别声明:
本站属于公益性网站,纯粹个人原因(陪孩子学习便于查询和教授),网站部分内容收集于网络,仅供学生和老师参考、交流使用,请勿用作其他商业收费用途。
如果网站内容能给你带来提升,那便是我经营此网站的初衷。网站相关内容如有问题,请及时提出,我在此谢谢!
本站尊重原创并对原创者的文章表示肯定和感谢,如有侵权请联系删除!针对本站原创内容,本站也欢迎转载,如需转载请注明出处。